A fájdalomérzékelés, vagy nocicepció, egy összetett folyamat, melynek során a szervezet érzékeli és feldolgozza a potenciálisan káros ingereket. Ennek a folyamatnak a kulcsszereplői a nociceptorok, vagy fájdalomreceptorok.
Ezek a speciális idegvégződések a test szöveteiben találhatók, beleértve a bőrt, az izmokat, az ízületeket és a belső szerveket. Feladatuk, hogy érzékeljék a különböző típusú káros ingereket, mint például a mechanikai sérülések (vágás, nyomás), a hőmérsékleti szélsőségek (égés, fagyás) és a kémiai irritációk (gyulladásos anyagok).
A nociceptorok nem egyformák; különböző típusúak léteznek, melyek eltérő ingerekre specializálódtak. Vannak például mechanoreceptorok, melyek a nyomásra és a feszülésre reagálnak, termoreceptorok, melyek a hőmérséklet változásait érzékelik, és kemoreceptorok, melyek a kémiai anyagok jelenlétét jelzik.
Amikor egy nociceptor aktiválódik, elektromos jelet küld a gerincvelőbe és az agyba. Ez a jel az idegrostokon keresztül terjed, melyeket A-delta és C-rostok alkotnak. Az A-delta rostok vastagabbak és gyorsabban vezetik az impulzusokat, így éles, lokalizált fájdalmat közvetítenek. Ezzel szemben a C-rostok vékonyabbak és lassabban vezetik az impulzusokat, ami tompa, elhúzódó fájdalomérzetet eredményez.
A nocicepció nem csupán egy passzív válasz a káros ingerekre, hanem egy aktív, modulálható folyamat, melyet számos tényező befolyásolhat, beleértve a genetikai hajlamot, a korábbi tapasztalatokat és a pszichológiai állapotot.
A gerincvelőben a fájdalomjelek továbbítódnak az agy különböző területeire, ahol a fájdalomérzet tudatossá válik és feldolgozásra kerül. Ezek az agyi területek felelősek a fájdalom intenzitásának, helyének és minőségének meghatározásáért, valamint az érzelmi és viselkedéses válaszokért.
A nociceptorok definíciója és funkciója
A nociceptorok speciális szenzoros neuronok, amelyek a test szöveteiben találhatók, és a potenciálisan káros ingerekre reagálnak. Ezek az ingerek lehetnek mechanikai (pl. erős nyomás), hőmérsékleti (pl. extrém hő vagy hideg) vagy kémiai (pl. gyulladásos anyagok) jellegűek.
A nociceptorok feladata, hogy ezeket a káros ingereket elektromos jelekké alakítsák át, amelyeket az idegrendszer, konkrétan az agy felé továbbítanak. Az agy ezeket a jeleket fájdalomként érzékeli, ami egy védelmi mechanizmus a test számára. A fájdalom jelzi, hogy valami nincs rendben, és ösztönzi az egyént a károsító tényező elkerülésére vagy megszüntetésére.
A nociceptorok kulcsszerepet játszanak a fájdalom érzékelésében, ami elengedhetetlen a túléléshez.
A nociceptorok különböző típusai léteznek, amelyek különböző ingerekre specializálódtak. Például vannak olyan nociceptorok, amelyek a hőre, mások a mechanikai ingerekre, és megint mások a kémiai ingerekre a legérzékenyebbek. Ez a specializáció lehetővé teszi a test számára, hogy pontosan érzékelje a károsító tényező típusát és helyét.
A nociceptorok típusai: mechanikai, termikus, kémiai és alvó nociceptorok
A nociceptorok, vagy fájdalomreceptorok, rendkívül specializált idegvégződések, amelyek a testünkben érzékelik a potenciálisan káros ingereket. Ezeket az ingereket aztán elektromos jelekké alakítják át, amelyeket az agy fájdalomként értelmez.
A nociceptorok többféle típusa létezik, amelyek különböző ingerekre reagálnak. A leggyakoribb típusok a következők:
- Mechanikai nociceptorok: Ezek a receptorok a fizikai sérülésekre, például vágásokra, ütődésekre vagy túlzott nyomásra reagálnak. Aktiválásuk fájdalomérzetet vált ki, amely figyelmeztet bennünket a szövetkárosodás kockázatára.
- Termikus nociceptorok: Ezek a receptorok a szélsőséges hőmérsékletváltozásokra érzékenyek, mind a forróságra, mind a hidegre. A túl magas vagy túl alacsony hőmérséklet károsíthatja a sejteket, ezért ezek a receptorok fontos szerepet játszanak a testünk védelmében.
- Kémiai nociceptorok: Ezek a receptorok a különféle kémiai anyagokra reagálnak, amelyek szövetkárosodást okozhatnak. Ilyenek lehetnek például a gyulladásos mediátorok, amelyek sérülés esetén szabadulnak fel, vagy a maró anyagok.
A nociceptorok aktiválódása elengedhetetlen a túléléshez, mivel lehetővé teszi számunkra, hogy elkerüljük a potenciálisan veszélyes helyzeteket és védjük a testünket a sérülésektől.
Egy kevésbé ismert, de egyre nagyobb figyelmet kapó típus az:
- Alvó nociceptorok: Ezek a receptorok nyugalmi állapotban vannak, és csak bizonyos körülmények között aktiválódnak, például gyulladás esetén. A gyulladás során felszabaduló anyagok szenzitizálják ezeket a receptorokat, ami azt eredményezi, hogy az addig ártalmatlan ingerek is fájdalmat okoznak. Ez a jelenség magyarázhatja a krónikus fájdalom egyes formáit, ahol a fájdalom a sérülés gyógyulása után is fennmarad.
Az egyes nociceptor típusok specifikus ioncsatornákkal és receptorokkal rendelkeznek, amelyek lehetővé teszik számukra, hogy szelektíven reagáljanak a megfelelő ingerekre. A TRPV1 receptor például egy hőérzékeny ioncsatorna, amely a termikus nociceptorokban található, és a forró ingerekre reagál. A ASIC csatornák pedig a mechanikai és kémiai nociceptorokban találhatók, és a savas kémhatású vagy nyomásváltozásokra reagálnak.
A nociceptorok által közvetített fájdalomérzet összetett folyamat, amely magában foglalja a perifériás idegrendszert, a gerincvelőt és az agyat. A fájdalomérzet mértéke függ az inger intenzitásától, a nociceptorok érzékenységétől és az agy feldolgozási folyamataitól.
A nociceptorok eloszlása a testben: bőr, izmok, ízületek, belső szervek
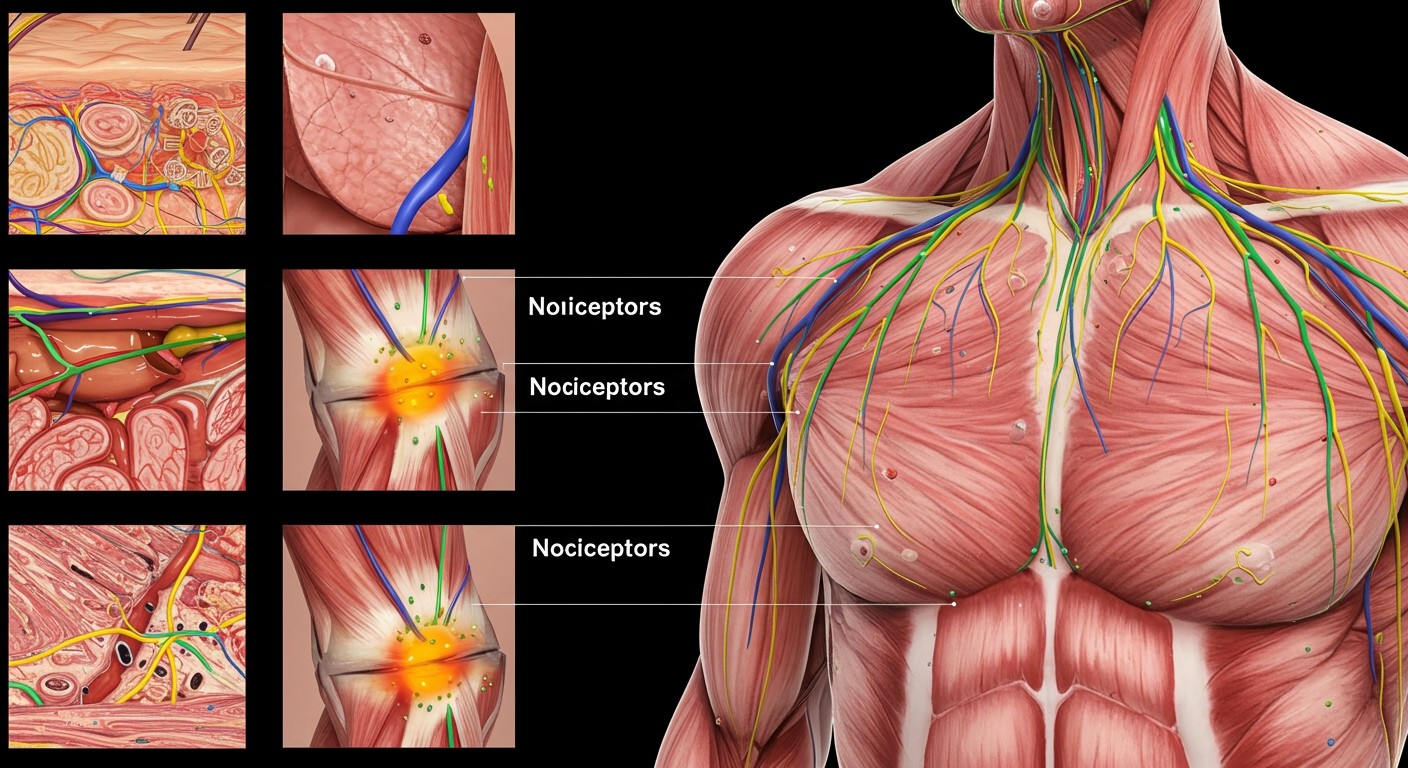
A nociceptorok, vagyis a fájdalomreceptorok, eloszlása a testben igen változatos, tükrözve az egyes területek sérülékenységét és fontosságát. A bőrben, különösen a felületi rétegekben, sűrűn találhatók nociceptorok. Ez teszi lehetővé, hogy gyorsan észleljük a potenciálisan káros ingereket, mint például a hő, a nyomás vagy a kémiai anyagok.
Az izmokban és ízületekben is jelentős számban vannak jelen nociceptorok. Ezek a receptorok a mozgással kapcsolatos fájdalmak érzékelésében játszanak kulcsszerepet, jelezve a túlterhelést, gyulladást vagy sérülést. Az ízületi tokokban található nociceptorok különösen fontosak az ízületi fájdalom érzékelésében, ami például az arthritis esetében jelentkezik.
A belső szervekben a nociceptorok eloszlása eltér a bőrhöz és az izmokhoz képest. Bár a belső szervekben kevesebb a nociceptor, mint a bőrben, ezek a receptorok rendkívül fontosak a belső sérülések és gyulladások jelzésében. A zsigeri fájdalom gyakran nehezen lokalizálható, mivel a belső szervek nociceptorjai más idegpályákon keresztül közvetítik az információt, mint a bőr receptorai.
A nociceptorok sűrűsége nem egyenletes a testben; a legérzékenyebb területeken, mint például az ujjak hegye és az ajkak, sokkal több található belőlük, mint a kevésbé érzékeny területeken.
Fontos megjegyezni, hogy a nociceptorok nem csak a fájdalom közvetlen érzékelésében játszanak szerepet, hanem a gyulladásos válasz kiváltásában és fenntartásában is. Sérülés esetén a nociceptorok által kibocsátott anyagok hozzájárulnak a helyi gyulladás kialakulásához, ami a szövetek gyógyulását segíti elő.
A fájdalom útvonala: transzdukció, transzmisszió, moduláció és percepció
A fájdalom érzékelése egy komplex folyamat, mely négy fő szakaszra osztható: transzdukció, transzmisszió, moduláció és percepció. Ezek a lépések egymásra épülve biztosítják, hogy a káros ingerekből származó információ eljusson az agyba, ahol fájdalomként érzékeljük.
A transzdukció során a nociceptorok, azaz a fájdalomreceptorok, a káros ingereket – mint például hő, nyomás vagy kémiai anyagok – elektromos jelekké alakítják át. Ezek az ingerek aktiválják a nociceptorok membránján található speciális ioncsatornákat, ami akciós potenciált generál.
A transzmisszió az akciós potenciálok továbbítását jelenti a perifériás idegeken keresztül a gerincvelőbe. A nociceptorok axonjai a gerincvelő hátsó szarvában szinapszisokat képeznek a második neuronokkal, melyek továbbítják a jelet az agytörzsbe és a thalamusba.
A fájdalomérzet nem csupán a káros inger jelenlétének egyszerű leképezése, hanem egy dinamikus és modulálható folyamat eredménye.
A moduláció során a fájdalomjelek felerősödhetnek vagy gyengülhetnek a gerincvelőben és az agyban. Ez a folyamat magában foglalja a gátló és serkentő neurotranszmitterek felszabadulását, melyek befolyásolják a fájdalomérzet intenzitását. Például az endorfinok, a szervezet saját fájdalomcsillapítói, gátolhatják a fájdalomjelek továbbítását.
Végül, a percepció az a folyamat, amikor az agy értelmezi a beérkező fájdalomjeleket. Ez a szakasz magában foglalja a tudatos fájdalomérzetet, valamint a fájdalomhoz kapcsolódó érzelmi és kognitív válaszokat. A fájdalom percepciója egyénenként eltérő lehet, és befolyásolhatja a korábbi tapasztalatok, a genetikai tényezők és a pszichológiai állapot.
A transzdukció mechanizmusa: ioncsatornák és receptorok szerepe
A nociceptorok, azaz a fájdalomreceptorok működésének kulcsfontosságú eleme a transzdukció. Ez a folyamat alakítja át a káros ingereket (pl. hő, nyomás, kémiai anyagok) elektromos jelekké, amelyeket az idegrendszer képes feldolgozni.
A transzdukció középpontjában az ioncsatornák és a receptorok állnak. Az ioncsatornák olyan fehérjék, amelyek a sejtmembránon áthaladva pórusokat képeznek. Ezek a pórusok szelektíven engedik át az ionokat (pl. nátrium, kálium, kalcium), ami megváltoztatja a sejtmembrán potenciálját.
Különböző típusú ioncsatornák érzékelik a különböző típusú káros ingereket. Például a TRPV1 receptor (Transient Receptor Potential Vanilloid 1) a hőre és bizonyos kémiai anyagokra (pl. kapszaicin, a csípős paprika hatóanyaga) érzékeny. Amikor a TRPV1 aktiválódik, ionok áramlanak a sejtbe, ami depolarizációt okoz, és akciós potenciált indít el.
Más receptorok közvetlenül a kémiai anyagokhoz kötődnek. Például a savérzékeny ioncsatornák (ASIC-k) a szövetkárosodás során felszabaduló savas környezetre reagálnak.
A nociceptorok érzékenysége modulálható. Gyulladás esetén például a szövetekben felszabaduló anyagok szenzitizálhatják a nociceptorokat, ami azt jelenti, hogy alacsonyabb küszöbértéknél is kiváltanak fájdalomérzetet.
A transzdukció folyamata rendkívül komplex és sokrétű, számos különböző ioncsatorna és receptor vesz részt benne. Az egyes receptorok szerepének és működésének megértése kulcsfontosságú a fájdalomcsillapító szerek fejlesztéséhez.
A transzmisszió idegpályái: A delta és C rostok szerepe
A fájdalomérzet továbbításában kulcsszerepet játszanak az A-delta és C rostok. Ezek a nociceptorok által generált idegi impulzusokat a gerincvelőbe szállítják.
Az A-delta rostok vastagabbak és mielinizáltak, ezért gyorsabban vezetik az impulzusokat. Ez a gyors vezetés felelős az éles, lokalizált fájdalomért, melyet gyakran „első fájdalomnak” is neveznek. Például, amikor megégetjük a kezünket, az A-delta rostok közvetítik az azonnali, szúró érzést.
Ezzel szemben a C rostok vékonyabbak és nem mielinizáltak, így lassabban vezetik az impulzusokat. Ezek a rostok a tompa, égő, elhúzódó fájdalomért felelősek, amelyet gyakran „második fájdalomnak” neveznek. Ugyanazon égési sérülés esetén a C rostok közvetítik a mélyebb, elhúzódó fájdalmat, ami az éles fájdalom után jelentkezik.
A különbség a két típusú rost sebességében és a közvetített fájdalom típusában lehetővé teszi, hogy a szervezetünk gyorsan reagáljon a káros ingerekre, majd hosszabb távon is érzékelje a sérülést.
A két rosttípus eltérő neurotranszmittereket használ a gerincvelőben történő szinaptikus átvitel során. Az A-delta rostok főként glutamátot szabadítanak fel, míg a C rostok glutamátot és neuropeptideket, például szubsztancia P-t.
A fájdalomérzet modulációjában mindkét rosttípus szerepet játszik. A gerincvelőben található gátló neuronok befolyásolhatják az A-delta és C rostok aktivitását, ezáltal csökkentve a fájdalom intenzitását. Az endogén opioidok például gátló hatást fejtenek ki a C rostokra, csökkentve a fájdalomérzetet.
A gerincvelői feldolgozás: a hátsó szarv és a fájdalomkapu elmélet
A nociceptorok által generált fájdalomjelek a gerincvelőbe érkeznek, ahol bonyolult feldolgozási folyamatokon mennek keresztül. A gerincvelő hátsó szarva kulcsfontosságú szerepet játszik ebben a folyamatban.
A hátsó szarv neuronjai fogadják a nociceptív információt az afferens idegrostoktól. Ezek a neuronok integrálják a beérkező jeleket, mielőtt továbbítanák azokat az agyba. A fájdalom intenzitása és jellege nagymértékben függ a hátsó szarvban zajló feldolgozástól.
A fájdalomkapu elmélet, melyet Ronald Melzack és Patrick Wall dolgoztak ki, megmagyarázza, hogyan modulálhatja a gerincvelő a fájdalomérzetet. Az elmélet szerint a hátsó szarvban található idegsejtek egyfajta „kapuként” működnek, amelyek szabályozzák, hogy a fájdalomjelek eljutnak-e az agyba.
A fájdalomkapu elmélet lényege, hogy a nem-nociceptív ingerek (pl. érintés, nyomás) gátolhatják a nociceptív ingerek továbbítását, ezáltal csökkentve a fájdalomérzetet.
Ezt a gátlást az Aβ rostok közvetítik, amelyek a nem-fájdalmas ingereket továbbítják. Amikor ezek a rostok aktiválódnak, gátolják a C rostok és Aδ rostok (amelyek a fájdalomjeleket szállítják) aktivitását a hátsó szarvban. Ez a gátlás csökkenti a fájdalomérzetet.
Például, ha megütjük magunkat, ösztönösen dörzsöljük a fájdalmas területet. Ez a dörzsölés aktiválja az Aβ rostokat, ami segít „bezárni” a fájdalomkaput, és enyhíti a fájdalmat. A fájdalomkapu elmélet rávilágít arra, hogy a fájdalomérzet nem pusztán a szövetkárosodás mértékétől függ, hanem a gerincvelőben zajló modulációs folyamatoktól is.
Az agyi fájdalomközpontok: talamusz, szomatoszenzoros kéreg, limbikus rendszer
A nociceptorok által közvetített fájdalomjelzés bonyolult útvonalon jut el az agyba, ahol különböző központok dolgozzák fel az információt. Ezek közül kiemelkedő szerepet játszik a talamusz, a szomatoszenzoros kéreg és a limbikus rendszer.
A talamusz a fájdalomérzet elsődleges feldolgozó állomása. Ide érkeznek a nociceptorokból származó afferens idegrostok, és itt történik a fájdalomjelzés szűrése és továbbítása az agykéreg felé. A talamusz nem csak továbbít, hanem részt vesz a fájdalom intenzitásának és lokalizációjának kezdeti értékelésében is.
A szomatoszenzoros kéreg, különösen az S1 és S2 területek, a fájdalomérzet pontos helyének meghatározásáért és a fájdalom jellegének (pl. éles, tompa, lüktető) azonosításáért felelősek. Ez a kéregterület teszi lehetővé, hogy tudatosuljon bennünk, hol fáj, és milyen érzés a fájdalom.
A szomatoszenzoros kéreg károsodása esetén a fájdalom lokalizációja és a fájdalom jellegének azonosítása sérülhet.
A limbikus rendszer, amelybe a hipotalamusz, az amigdala és a hippocampus tartozik, a fájdalom érzelmi és motivációs aspektusait dolgozza fel. Az amigdala felelős a fájdalomhoz kapcsolódó félelem és szorongás kialakulásáért, míg a hippocampus a fájdalommal kapcsolatos emlékek rögzítésében játszik szerepet. A hipotalamusz pedig a fájdalomra adott vegetatív válaszokat (pl. szívritmus emelkedése, izzadás) szabályozza.
Ezen központok közötti komplex interakció biztosítja, hogy a fájdalmat ne csak fizikai érzetként éljük meg, hanem érzelmi és viselkedéses reakciók is társuljanak hozzá. A krónikus fájdalom esetében ezek az agyi területek átalakulhatnak, ami a fájdalomérzet tartós fennmaradásához vezethet. A fájdalom feldolgozásában részt vevő agyi területek feltérképezése kulcsfontosságú a hatékony fájdalomcsillapító terápiák kidolgozásához.
A fájdalom modulációja: endogén opioidok és más neurotranszmitterek
A nociceptorok által kiváltott fájdalomérzet nem egy egyszerű, lineáris folyamat. A fájdalom intenzitása jelentősen modulálható a központi idegrendszerben, számos neurotranszmitter segítségével. Az egyik legfontosabb ilyen rendszer az endogén opioid rendszer.
Az endogén opioidok, mint például az endorfinok, enkefalinok és dinorfinok, a szervezet saját fájdalomcsillapítói. Ezek a neurotranszmitterek a gerincvelőben és az agyban található opioid receptorokhoz kötődve csökkentik a nociceptorokból érkező fájdalomjeleket. Ez a folyamat preszinaptikus gátlással történik, azaz csökkentik a fájdalmat közvetítő neurotranszmitterek (pl. glutamát, substance P) felszabadulását.
Az endogén opioid rendszer aktiválása magyarázza a placebo hatást és a stressz által kiváltott fájdalomcsillapítást (stressz-indukált analgézia).
Más neurotranszmitterek is szerepet játszanak a fájdalom modulációjában. Például a szerotonin és a noradrenalin, melyek a leszálló gátló pályákban találhatók, szintén csökkenthetik a fájdalomérzetet. Ezek a neurotranszmitterek a gerincvelőben hatnak, gátolva a nociceptív jelek továbbítását az agy felé. A krónikus fájdalom kezelésében gyakran alkalmaznak olyan gyógyszereket, amelyek a szerotonin és a noradrenalin szintjét növelik az idegrendszerben.
Ezen túlmenően, a GABA (gamma-amino-vajsav) is fontos szerepet játszik a fájdalom gátlásában. A GABA egy gátló neurotranszmitter, amely csökkenti az idegsejtek aktivitását, ezáltal a fájdalomérzetet is. A GABAerg rendszer zavarai hozzájárulhatnak a krónikus fájdalom kialakulásához.
A fájdalomérzékelés egyéni különbségei: genetikai és pszichológiai tényezők
A nociceptorok által közvetített fájdalomérzékelés nagymértékben egyéni. Ugyanaz a fizikai inger két különböző emberben eltérő fájdalomérzetet válthat ki. Ennek hátterében komplex genetikai és pszichológiai tényezők állnak.
A genetikai hajlam kulcsszerepet játszik a fájdalomküszöb meghatározásában. Számos gén befolyásolja a nociceptorok működését, a neurotranszmitterek termelését és a fájdalomjel átvitelét az agyba. Bizonyos genetikai variációk érzékenyebbé tehetnek valakit a fájdalomra, míg mások toleránsabbá.
A pszichológiai tényezők, mint például a stressz, a szorongás, a depresszió és a korábbi fájdalomélmények, szintén jelentősen befolyásolják a fájdalomérzékelést. A krónikus stressz például fokozhatja a fájdalomérzékenységet, míg a pozitív gondolkodás és a relaxációs technikák csökkenthetik azt.
A fájdalomérzékelés nem csupán a nociceptorok aktivitásától függ, hanem az egyén genetikai örökségétől, pszichés állapotától és korábbi tapasztalataitól is.
A placebo hatás is jól mutatja a pszichológiai tényezők erejét a fájdalomcsillapításban. Egy hatástalan kezelés is képes csökkenteni a fájdalmat, ha a páciens hisz a hatékonyságában.
A szociokulturális tényezők is szerepet játszhatnak a fájdalomérzékelésben és a fájdalom kifejezésében. Különböző kultúrákban eltérő normák vonatkoznak a fájdalommal való megküzdésre és a fájdalom kommunikálására.
A fájdalomérzékelés egyéni különbségeinek megértése elengedhetetlen a hatékony fájdalomkezeléshez. A személyre szabott terápiák, amelyek figyelembe veszik a genetikai és pszichológiai tényezőket, nagyobb eséllyel vezetnek sikerre.
A krónikus fájdalom és a nociceptorok szerepe
A krónikus fájdalom gyakran a nociceptorok túlzott aktivitásából ered. Normális esetben a nociceptorok a szövetkárosodásra reagálnak, figyelmeztetve a szervezetet a veszélyre. Krónikus fájdalom esetén azonban ezek a receptorok folyamatosan aktiválódhatnak, még akkor is, ha nincs jelen tényleges szövetkárosodás.
Ez a folyamatos aktiváció a nociceptorok szenzitizációjához vezethet. A szenzitizáció azt jelenti, hogy a receptorok érzékenyebbé válnak a stimulációra, ami azt eredményezi, hogy a korábban ártalmatlan ingerek is fájdalmat okozhatnak (allodínia), vagy a fájdalmas ingerek intenzívebbnek érződnek (hyperalgesia).
A krónikus fájdalomban szenvedő betegek esetében a nociceptorok szerepe kulcsfontosságú, mivel a fájdalomérzet fenntartásában játszanak központi szerepet.
A krónikus fájdalom kezelése gyakran a nociceptorok aktivitásának csökkentésére, vagy a fájdalomjelek agyba történő továbbításának gátlására irányul. Számos gyógyszer és terápia létezik, amelyek ezen a mechanizmuson keresztül fejtik ki hatásukat, beleértve a nem-szteroid gyulladáscsökkentőket (NSAID-ok), az opioidokat és a idegblokádokat.
Nociceptor diszfunkció: allodínia, hiperalgézia és más fájdalomzavarok
A nociceptorok diszfunkciója számos fájdalomzavar kialakulásához vezethet. Ezek a zavarok jelentősen befolyásolhatják az életminőséget, és a krónikus fájdalom egyik fő okát jelentik.
Az allodínia egy olyan állapot, amikor ártalmatlan ingerek fájdalmat váltanak ki. Például egy könnyű érintés vagy a ruha súrlódása is fájdalmas lehet. Ez azért történik, mert a nociceptorok érzékenysége megnő, vagy a fájdalomjelek feldolgozása az agyban megváltozik.
A hiperalgézia a fájdalomérzet fokozódása olyan ingerekre, amelyek normálisan csak enyhe fájdalmat okoznak. Tehát egy kis ütés sokkal erősebb fájdalmat okoz, mint amilyet általában várnánk. A hiperalgézia gyakran gyulladással jár, ami tovább fokozza a nociceptorok érzékenységét.
A nociceptorok diszfunkciója az idegrendszer károsodása vagy gyulladás következtében alakulhat ki, ami a fájdalomérzékelés megváltozásához vezet.
Más fájdalomzavarok, mint például a neuropátiás fájdalom, szintén a nociceptorok és a fájdalomérzékelő idegpályák károsodásával függnek össze. Ebben az esetben a fájdalom gyakran égő, szúró vagy lüktető jellegű, és spontán módon jelentkezhet, inger nélkül is. A fantomfájdalom, amely amputáció után jelentkezik, szintén a nociceptorok és az agy közötti kommunikáció zavarából eredhet.
Ezen fájdalomzavarok kezelése komplex feladat, és gyakran multidiszciplináris megközelítést igényel, beleértve a gyógyszeres terápiát, a fizikoterápiát és a pszichoterápiát is. A cél a fájdalom csökkentése, a funkció javítása és az életminőség helyreállítása.
A fájdalomcsillapítás módszerei: gyógyszeres és nem gyógyszeres kezelések
A nociceptorok által közvetített fájdalomérzet csillapítására számos gyógyszeres és nem gyógyszeres módszer áll rendelkezésünkre. A gyógyszeres kezelések célja a fájdalomjel átvitelének blokkolása vagy a fájdalomérzékelés modulálása az agyban. Ide tartoznak a nem-szteroid gyulladáscsökkentők (NSAID-ok), melyek a periférián csökkentik a gyulladást és a fájdalmat, valamint az opioidok, melyek az agyban hatnak a fájdalomérzetre.
A nem gyógyszeres kezelések közé tartozik a fizioterápia, mely segíthet az izmok erősítésében és a mozgástartomány javításában, ezáltal csökkentve a fájdalmat. A transzkután elektromos idegstimuláció (TENS) egy másik módszer, mely elektromos impulzusokkal stimulálja az idegeket, ezáltal blokkolva a fájdalomjeleket. A pszichológiai terápiák, mint például a kognitív viselkedésterápia (CBT) és a relaxációs technikák, szintén hatékonyak lehetnek a krónikus fájdalom kezelésében.
A fájdalomcsillapítás során a cél a fájdalom intenzitásának csökkentése és az életminőség javítása, figyelembe véve a beteg egyéni szükségleteit.
A megfelelő kezelési terv kidolgozása érdekében fontos a fájdalom okának pontos diagnosztizálása és a beteggel való szoros együttműködés. A fájdalom kezelése gyakran multidiszciplináris megközelítést igényel, melyben orvosok, fizioterapeuták és pszichológusok is részt vesznek.
A jövő fájdalomkutatási irányai: célzott terápiák és új fájdalomcsillapítók
A nociceptorok, azaz a fájdalomreceptorok megértése kulcsfontosságú a jövőbeli fájdalomterápiák fejlesztéséhez. A kutatások fókuszában a célzott terápiák állnak, melyek a fájdalom kialakulásának pontos helyén és mechanizmusán hatnak.
Ez a megközelítés lehetővé teszi, hogy elkerüljük a hagyományos fájdalomcsillapítók mellékhatásait, melyek gyakran az egész szervezetre kiterjedő hatással bírnak. Például, a kutatók olyan molekuláris célpontokat keresnek a nociceptorokon, melyek specifikusan a fájdalomérzetért felelősek.
A jövőben várhatóan olyan új fájdalomcsillapítók jelennek meg, melyek a nociceptorok specifikus alcsoportjait célozzák meg, így minimalizálva a nem kívánt hatásokat.
Emellett a genetikai kutatások is fontos szerepet játszanak. A fájdalomérzékelésben szerepet játszó gének azonosítása lehetővé teszi a személyre szabott terápiák kidolgozását. A génterápia potenciális megoldást jelenthet a krónikus fájdalomban szenvedők számára, mivel a nociceptorok működését genetikai szinten befolyásolhatja.
A neuroplaszticitás, az agy fájdalomra adott válaszának megváltoztathatósága szintén egy fontos kutatási terület. A cél olyan terápiák kifejlesztése, melyek az agy fájdalomfeldolgozó központjait befolyásolva csökkentik a fájdalomérzetet.
Bár minden tőlünk telhetőt megteszünk azért, hogy a bemutatott témákat precízen dolgozzuk fel, tévedések lehetségesek. Az itt közzétett információk használata minden esetben a látogató saját felelősségére történik. Felelősségünket kizárjuk minden olyan kárért, amely az információk alkalmazásából vagy ajánlásaink követéséből származhat.