A szinaptikus rés az a mikroszkopikus tér, ami elválasztja egymástól a két idegsejtet (neuront). Ez a rés kulcsfontosságú az idegrendszeri kommunikációban, mivel lehetővé teszi, hogy az egyik neuron (az preszinaptikus neuron) üzenetet küldjön a másiknak (a posztszinaptikus neuronnak).
A folyamat úgy zajlik, hogy a preszinaptikus neuron ingerület hatására neurotranszmittereket szabadít fel a szinaptikus résbe. Ezek a kémiai anyagok áthaladnak a résen, és a posztszinaptikus neuron membránján található receptorokhoz kötődnek. Ez a kötődés ioncsatornákat nyithat meg, vagy más intracelluláris jelátviteli útvonalakat aktiválhat, aminek eredményeként a posztszinaptikus neuronban ingerület keletkezik.
A szinaptikus rés tehát nem csupán egy üres tér, hanem egy dinamikus helyszín, ahol a neurotranszmitterek koncentrációja és receptorok állapota folyamatosan változik, befolyásolva az idegrendszeri működést.
A neurotranszmitterek hatása nem tart örökké. Miután kifejtették hatásukat, eltávolításra kerülnek a résből. Ez történhet visszavétellel a preszinaptikus neuronba, enzimatikus lebontással a résben, vagy diffúzióval a környező szövetekbe. Ez a folyamat szabályozza a jelátvitel időtartamát és intenzitását.
A szinaptikus rés működése számos betegségben érintett, beleértve a depressziót, a szorongást és a Parkinson-kórt. A gyógyszerek gyakran a szinaptikus résben lévő neurotranszmitterekre hatnak, hogy helyreállítsák az idegrendszer egyensúlyát.
A szinapszisok alapvető felépítése: pre- és posztszinaptikus elemek
A szinaptikus rés a két idegsejt közötti apró tér, ahol az idegsejtek kommunikációja zajlik. Pontosabban, ez a tér választja el a preszinaptikus (üzenetet küldő) idegsejt membránját a posztszinaptikus (üzenetet fogadó) idegsejt membránjától.
Amikor egy akciós potenciál eléri a preszinaptikus idegsejt végét (az axon terminálist), kalciumionok áramlanak be a sejtbe. Ez a kalciumbeáramlás elindítja a neurotranszmittereket tartalmazó vezikulák (apró hólyagok) fúzióját a preszinaptikus membránnal. A neurotranszmitterek ezután felszabadulnak a szinaptikus résbe.
A szinaptikus résen keresztül diffundálva a neurotranszmitterek elérik a posztszinaptikus idegsejt membránján található receptorokat.
A neurotranszmitterek kötődése a receptorokhoz ioncsatornákat nyithat a posztszinaptikus membránban, ami ionok áramlását teszi lehetővé a sejtbe vagy a sejtből. Ez a folyamat depolarizációt (serkentő hatás) vagy hiperpolarizációt (gátló hatás) okozhat a posztszinaptikus sejtben, attól függően, hogy milyen ionok áramlanak át a membránon és milyen receptorhoz kötődött a neurotranszmitter.
A neurotranszmitterek hatása a szinaptikus résben nem tart örökké. A neurotranszmitterek eltávolítására különböző mechanizmusok léteznek, mint például a visszavétel (reuptake) a preszinaptikus sejtbe, enzimatikus lebontás a szinaptikus résben, vagy diffúzió a résből.
A szinaptikus rés definíciója és mérete
A szinaptikus rés egy apró, 20-40 nanométeres űr, amely elválasztja a neuronokat egymástól a szinapszisokban. Ez a mikroszkopikus távolság kulcsfontosságú a kémiai szinaptikus jelátvitelhez. Nem közvetlen fizikai kapcsolatról van szó, hanem egy térről, ahol a neurotranszmitterek közvetítik az információt.
A szinaptikus rés a neuronok közötti kommunikáció elengedhetetlen eleme, lehetővé téve a jelátvitelt anélkül, hogy a sejtek fizikailag érintkeznének.
A rés mérete pontosan szabályozott, mivel befolyásolja a neurotranszmitterek diffúziójának sebességét és koncentrációját. A megfelelő méret biztosítja, hogy a neurotranszmitterek hatékonyan jussanak el a posztszinaptikus neuron receptoraihoz, de ne szóródjanak szét túl gyorsan.
A szinaptikus rés tartalmaz extracelluláris mátrixot is, amely különféle fehérjéket foglal magában, és szerepet játszik a szinapszisok szerkezetének fenntartásában, valamint a neurotranszmitterek lebontásában vagy eltávolításában. Ez a mátrix biztosítja a rés stabilitását és szabályozza a neurotranszmitterek aktivitását.
A neurotranszmitterek szintézise és tárolása a preszinaptikus neuronban
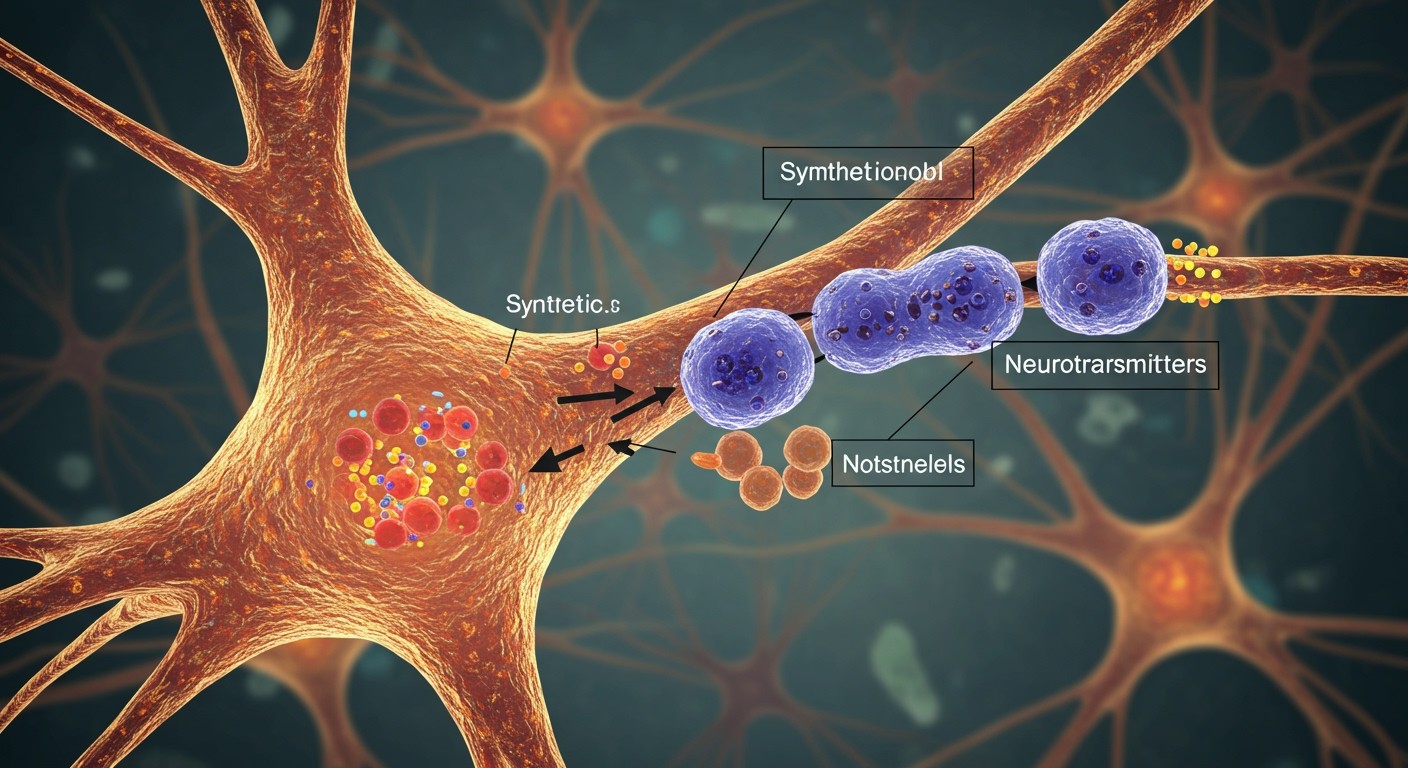
A preszinaptikus neuron kulcsszerepet játszik a szinaptikus jelátvitelben, mivel itt történik a neurotranszmitterek szintézise és tárolása. Ez a folyamat elengedhetetlen ahhoz, hogy az idegsejt képes legyen továbbítani az információt a szinaptikus résen keresztül a posztszinaptikus neuron felé.
A neurotranszmitterek szintézise bonyolult biokémiai folyamatok sorozatát foglalja magában. A folyamat általában a neuron citoplazmájában kezdődik, ahol enzimek katalizálják a prekurzor molekulák átalakulását a megfelelő neurotranszmitterré. Például, az acetilkolin szintézise során az acetil-CoA és a kolin egyesül acetilkolin-transzferáz enzim jelenlétében.
A szintetizált neurotranszmitterek ezután vezikulákba kerülnek. Ezek a vezikulák kis, membránnal határolt zsákocskák, amelyek a neurotranszmittereket védik a lebomlástól és lehetővé teszik a szabályozott kibocsátást. A neurotranszmitterek vezikulákba történő bejutását speciális transzporter fehérjék segítik, amelyek a vezikula membránjában találhatók.
A vezikulák tárolása és készenléte kritikus a gyors és hatékony szinaptikus jelátvitelhez.
A vezikulák a preszinaptikus terminálban, a szinaptikus rés közelében helyezkednek el. Kétféle vezikula-pool létezik: a rezerv pool és a readily releasable pool. A readily releasable pool vezikulái közvetlenül a szinaptikus membránhoz kapcsolódnak, és készen állnak a kibocsátásra, míg a rezerv pool vezikulái távolabb helyezkednek el, és szükség esetén mobilizálódnak.
A neurotranszmitterek felszabadulása a preszinaptikus terminál depolarizációja következtében indul meg. Amikor egy akciós potenciál eléri a terminált, feszültségfüggő kalcium csatornák nyílnak, és kalcium ionok áramlanak be a sejtbe. A megnövekedett intracelluláris kalcium koncentráció elindítja a vezikulák fúzióját a preszinaptikus membránnal, ami a neurotranszmitterek kibocsátásához vezet a szinaptikus résbe. Ezt a folyamatot exocitózisnak nevezzük.
A neurotranszmitterek kibocsátása után a vezikulák membránja újrahasznosításra kerül, ami lehetővé teszi a preszinaptikus neuron számára, hogy gyorsan feltöltse a neurotranszmitter készleteit. Ezt a folyamatot endocitózisnak nevezzük.
Akciós potenciál érkezése és a kalciumionok szerepe a preszinaptikus végződésben
A szinaptikus rés a két idegsejt (neuron) közötti parányi tér, ahol az egyik sejt (preszinaptikus) jelet küld a másiknak (posztszinaptikus). Amikor egy akciós potenciál eléri a preszinaptikus végződést, bonyolult eseménysorozat indul el.
Az akciós potenciál depolarizálja a preszinaptikus membránt, ami megnyitja a feszültségfüggő kalciumcsatornákat. Ezek a csatornák lehetővé teszik, hogy a kalciumionok (Ca2+) beáramoljanak a sejtbe a sejten kívüli térből. A kalciumionok koncentrációja a preszinaptikus végződésben hirtelen megnő.
A megnövekedett kalciumion-koncentráció kulcsfontosságú a neurotranszmitterek felszabadulásához.
A kalciumionok kötődnek a szinaptotagmin nevű fehérjéhez, amely a neurotranszmittereket tartalmazó vezikulumok membránján található. Ez a kötődés elindítja a vezikulumok fúzióját a preszinaptikus membránnal. A fúzió során a vezikulumok tartalma, a neurotranszmitterek, a szinaptikus résbe ürülnek.
Minél több kalciumion áramlik be, annál több vezikulum fúzionál a membránnal, és annál több neurotranszmitter szabadul fel. A felszabadult neurotranszmitterek diffundálnak át a szinaptikus résen, és kötődnek a posztszinaptikus membránon található receptorokhoz, így közvetítve a jelet a következő neuron felé. A kalciumionok beáramlása tehát közvetlen kapcsolatot teremt az idegimpulzus érkezése és a neurotranszmitterek felszabadulása között.
A neurotranszmitterek felszabadulása a szinaptikus résbe: exocitózis
A neurotranszmitterek felszabadulása a szinaptikus résbe a neuronok közötti kommunikáció egyik kulcsfontosságú lépése. Ez a folyamat az exocitózis révén valósul meg, ami egy rendkívül szabályozott mechanizmus.
Amikor egy akciós potenciál eléri a preszinaptikus idegvégződést, feszültségfüggő kalciumcsatornák nyílnak meg. A kalciumionok beáramlása a sejtbe drasztikusan megnöveli a kalcium koncentrációját a preszinaptikus terminálban.
Ez a megnövekedett kalcium koncentráció elindít egy sor eseményt, melynek eredményeként a neurotranszmittereket tartalmazó szinaptikus vezikulák a sejtmembránhoz vándorolnak. A vezikulák membránja ezután egyesül a preszinaptikus membránnal, kialakítva egy átmeneti pórust.
Ezen a póruson keresztül a neurotranszmitterek a szinaptikus résbe ürülnek.
Ezt a folyamatot számos fehérje szabályozza, beleértve a SNARE fehérjéket (soluble N-ethylmaleimide-sensitive factor attachment protein receptor). A SNARE fehérjék specifikusan kölcsönhatásba lépnek egymással, biztosítva a vezikula pontos dokkolását és fúzióját a membránnal.
A neurotranszmitterek felszabadulása után diffundálnak a szinaptikus résen keresztül, és kötődnek a posztszinaptikus neuron receptoraihoz. Ez a kötődés elindít egy posztszinaptikus választ, ami lehet serkentő vagy gátló, attól függően, hogy milyen neurotranszmitter és receptor kombinációról van szó.
Végül, a neurotranszmitterek eltávolításra kerülnek a szinaptikus résből, különböző mechanizmusok révén, mint például a visszavétel a preszinaptikus neuronba, az enzimatikus lebontás, vagy a glia sejtek általi felvétel. Ez a folyamat biztosítja a jelzés pontos leállítását és a szinaptikus transzmisszió szabályozását.
A neurotranszmitterek diffúziója a szinaptikus résen keresztül
A szinaptikus rés egy mikroszkopikus tér a preszinaptikus (küldő) és a posztszinaptikus (fogadó) neuron között. Ezen a résen keresztül történik az idegrendszeri információátadás.
Az információátadás kulcsfontosságú eleme a neurotranszmitterek diffúziója.
A preszinaptikus neuron akciós potenciálja kiváltja a neurotranszmitterek felszabadulását a szinaptikus résbe. Ezek a molekulák ezután a résen keresztül diffundálnak, ami egy viszonylag rövid időt vesz igénybe a kis távolság miatt. A diffúzió sebességét befolyásolja a neurotranszmitter molekulamérete, a hőmérséklet és a közeg viszkozitása.
Amikor a neurotranszmitterek elérik a posztszinaptikus membránt, receptorokhoz kötődnek. Ez a kötődés kiváltja a posztszinaptikus neuronban a megfelelő választ, például ioncsatornák megnyílását, ami depolarizációhoz vagy hiperpolarizációhoz vezethet. A neurotranszmitterek eltávolítása a résből esszenciális a jelátvitel lezárásához és a folyamatos stimuláció elkerüléséhez. Ez történhet enzimatikus lebontással, visszavétellel a preszinaptikus neuronba, vagy a glia sejtek általi felvétellel.
Neurotranszmitter receptorok típusai: ionotróp és metabotróp receptorok
A szinaptikus résben felszabaduló neurotranszmitterek a posztszinaptikus membránon található receptorokhoz kötődnek. Ezek a receptorok alapvetően két fő típusba sorolhatók: ionotróp és metabotróp receptorok.
Az ionotróp receptorok ligand-vezérelt ioncsatornák. Amikor egy neurotranszmitter (ligandum) kötődik hozzájuk, az ioncsatorna kinyílik, lehetővé téve ionok (például Na+, K+, Cl–, Ca2+) áramlását a sejtmembránon keresztül. Ez gyors változást eredményez a membránpotenciálban, ami excitatorikus posztszinaptikus potenciál (EPSP) vagy inhibitorikus posztszinaptikus potenciál (IPSP) kialakulásához vezethet.
A metabotróp receptorok, más néven G-protein-kapcsolt receptorok (GPCR-ek), komplexebb módon működnek. Amikor egy neurotranszmitter kötődik egy metabotróp receptorhoz, az aktivál egy intracelluláris G-proteint. Ez a G-protein ezután aktiválhat egy enzimet, ami másodlagos hírvivők (például cAMP, IP3) termelődéséhez vezet. Ezek a másodlagos hírvivők aztán számos intracelluláris folyamatot befolyásolhatnak, beleértve az ioncsatornák nyitását vagy zárását, a génexpressziót és más celluláris funkciókat. A metabotróp receptorok hatása általában lassabb és tartósabb, mint az ionotróp receptoroké.
A metabotróp receptorok nem közvetlenül nyitják vagy zárják az ioncsatornákat, hanem közvetetten, egy G-protein és másodlagos hírvivők által fejtik ki hatásukat.
A két receptor típus közötti különbség jelentős a neurális kommunikáció szempontjából. Az ionotróp receptorok gyors, pontszerű válaszokat tesznek lehetővé, míg a metabotróp receptorok modulálják a neurális aktivitást hosszabb időtartamra, és befolyásolhatják a sejtek belső működését.
Például, a glutamát, a leggyakoribb excitatorikus neurotranszmitter az agyban, mindkét típusú receptorhoz kötődhet. Az AMPA és NMDA receptorok ionotrópok, és gyors EPSP-ket generálnak. A mGluR receptorok metabotrópok, és modulálják a szinaptikus transzmissziót és a plaszticitást.
A neurotranszmitterek kötődése a posztszinaptikus receptorokhoz és a jelátvitel megindulása
A szinaptikus rés a két idegsejt (preszinaptikus és posztszinaptikus sejt) közötti apró tér, ahol a jelátvitel zajlik. Amikor egy akciós potenciál eléri a preszinaptikus sejtet, az neurotranszmittereket szabadít fel a szinaptikus résbe.
Ezek a neurotranszmitterek a résen keresztül diffundálnak, és kötődnek a posztszinaptikus sejt membránján található specifikus receptorokhoz. A receptorok a neurotranszmitterekhez való kötődésükkel ioncsatornákat nyithatnak, vagy más intracelluláris jelátviteli útvonalakat aktiválhatnak.
A neurotranszmitter és a receptor közötti kötődés olyan, mint egy kulcs és egy zár: csak a megfelelő neurotranszmitter tud kötődni a megfelelő receptorhoz. Ez a szelektivitás biztosítja, hogy a jelátvitel pontos és célzott legyen.
A neurotranszmitterek kötődése a posztszinaptikus receptorokhoz megváltoztatja a posztszinaptikus sejt membránpotenciálját, ami excitációs posztszinaptikus potenciált (EPSP) vagy inhibíciós posztszinaptikus potenciált (IPSP) eredményezhet.
Az EPSP depolarizálja a sejtet, növelve az akciós potenciál kialakulásának valószínűségét, míg az IPSP hiperpolarizálja a sejtet, csökkentve az akciós potenciál kialakulásának valószínűségét. A posztszinaptikus sejtbe érkező EPSP-k és IPSP-k összeadódnak, és ha a küszöbértéket eléri a membránpotenciál, akkor akciós potenciál alakul ki, és a jel továbbterjed.
A neurotranszmitterek hatása a szinaptikus résben nem tart örökké. A neurotranszmitterek eltávolításra kerülnek a résből különböző mechanizmusok révén, például visszavétel a preszinaptikus sejtbe, enzimatikus lebontás, vagy diffúzió a környező szövetekbe. Ez a folyamat biztosítja, hogy a jelátvitel időben korlátozott legyen, és az idegsejt készen álljon a következő jel fogadására.
A posztszinaptikus potenciálok: EPSP és IPSP
A szinaptikus résen keresztül történő kommunikáció során a posztszinaptikus membránon potenciálváltozások keletkeznek. Ezek a változások lehetnek serkentő (excitatorikus) vagy gátló (inhibitorikus) hatásúak, melyek az idegsejt ingerelhetőségét befolyásolják.
A serkentő posztszinaptikus potenciál (EPSP) a membrán depolarizációját idézi elő, azaz közelebb viszi a sejtet a küszöbpotenciálhoz, növelve az akciós potenciál kiváltásának valószínűségét. Ezt leggyakrabban a Na+ ionok beáramlása okozza a sejtbe a neurotranszmitter által aktivált ioncsatornákon keresztül.
Ezzel szemben, a gátló posztszinaptikus potenciál (IPSP) a membrán hiperpolarizációját eredményezi, ami távolabb viszi a sejtet a küszöbpotenciáltól, csökkentve az akciós potenciál kiváltásának esélyét. Az IPSP-t gyakran a Cl– ionok beáramlása vagy a K+ ionok kiáramlása okozza.
Az EPSP és IPSP potenciálok lokális jelenségek, melyek a posztszinaptikus membrán egy adott pontján keletkeznek, és passzívan terjednek a sejtmembránon.
A posztszinaptikus neuron a beérkező EPSP-k és IPSP-k összegzését végzi el. Ha az EPSP-k dominálnak és az összegzés eredménye eléri a küszöbpotenciált, akkor akciós potenciál keletkezik. Ellenkező esetben, ha az IPSP-k dominálnak, az akciós potenciál kiváltása kevésbé valószínű.
A szinaptikus plaszticitás szerepe a tanulásban és a memóriában
A szinaptikus plaszticitás a szinapszisok erősségének változása az idegi aktivitás hatására. Ez a változékonyság kulcsfontosságú szerepet játszik a tanulásban és a memóriában. A szinaptikus rés, azaz a két neuron közötti aprócska tér (kb. 20-40 nanométer), a kommunikáció központi helyszíne.
Amikor egy akciós potenciál eléri a preszinaptikus neuront, az kalciumionok beáramlását idézi elő. Ez a kalcium beáramlás serkenti a neurotranszmitterek, például a glutamát vagy a GABA felszabadulását a preszinaptikus neuronból. Ezek a neurotranszmitterek diffundálnak a szinaptikus résen át a posztszinaptikus neuronhoz, ahol receptoraikhoz kötődnek.
A neurotranszmitterek kötődése a posztszinaptikus neuron receptoraihoz ioncsatornákat nyithat, ami depolarizációt (serkentő posztszinaptikus potenciál, EPSP) vagy hiperpolarizációt (gátló posztszinaptikus potenciál, IPSP) okozhat. Az EPSP-k növelik a posztszinaptikus neuronban az akciós potenciál kialakulásának valószínűségét, míg az IPSP-k csökkentik azt.
A szinaptikus plaszticitás hosszú távú formái, mint például a hosszú távú potencírozás (LTP) és a hosszú távú depresszió (LTD), tartós változásokat eredményeznek a szinaptikus kapcsolatok erősségében. Az LTP megerősíti a szinapszisokat, míg az LTD gyengíti azokat. Ez a dinamikus folyamat teszi lehetővé az agy számára, hogy alkalmazkodjon a tapasztalatokhoz és új információkat tároljon.
A szinaptikus résben zajló folyamatok finomhangolása, a neurotranszmitterek felszabadulásának és receptor kötődésének szabályozása, valamint a posztszinaptikus válaszok modulálása mind hozzájárul a tanulási és emlékezeti folyamatokhoz.
Például, az LTP gyakran jár együtt a posztszinaptikus neuronban található AMPA receptorok számának növekedésével. Ez azt jelenti, hogy a posztszinaptikus neuron érzékenyebbé válik a glutamátra, ami erősebb választ eredményez. Az LTD ezzel szemben az AMPA receptorok számának csökkenéséhez vezethet.
A szinaptikus résben zajló molekuláris mechanizmusok, mint például a fehérjeszintézis és a génexpresszió, szintén kulcsszerepet játszanak a hosszú távú szinaptikus plaszticitásban. Ezek a folyamatok lehetővé teszik az agy számára, hogy tartósan megváltoztassa a neuronok szerkezetét és működését, ami elengedhetetlen a hosszú távú emlékek kialakulásához.
A neurotranszmitterek eltávolítása a szinaptikus résből: visszavétel, enzimatikus lebontás és diffúzió
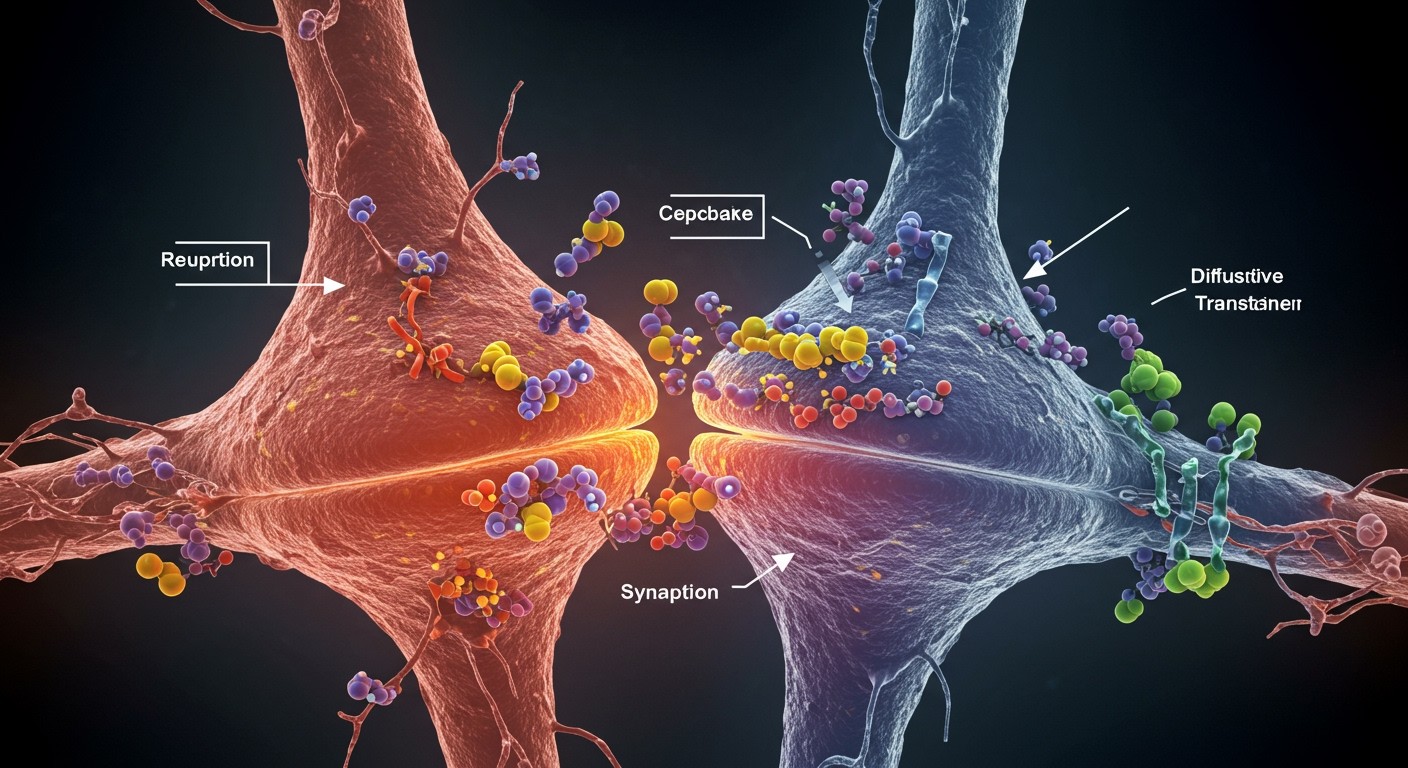
A szinaptikus rés egy apró, 20-40 nanométeres tér a preszinaptikus (küldő) és a posztszinaptikus (fogadó) neuron között. Miután a neurotranszmitterek felszabadultak a preszinaptikus neuronból, el kell távolítani őket a résből, hogy a szignalizáció ne tartson a végtelenségig. Erre három fő mechanizmus szolgál:
1. Visszavétel (Reuptake): A visszavétel során a neurotranszmitter molekulákat speciális transzporter fehérjék visszaszállítják a preszinaptikus neuronba. Ezek a transzporterek a sejtmembránban helyezkednek el, és szelektíven kötik meg az adott neurotranszmittert (például szerotonint, dopamint vagy noradrenalint). A visszaszállított neurotranszmitterek újra felhasználhatók vagy lebontásra kerülhetnek.
2. Enzimatikus lebontás: Bizonyos neurotranszmittereket enzimek bontanak le a szinaptikus résben. Például az acetilkolint az acetilkolin-észteráz enzim bontja acetáttá és kolinná. Ezek a lebontott termékek nem képesek aktiválni a posztszinaptikus receptorokat, így a szignalizáció megszakad. A kolin visszavételre kerülhet a preszinaptikus sejtbe, ahol újra acetilkolinná alakulhat.
3. Diffúzió: A neurotranszmitter molekulák egyszerűen eldiffundálhatnak a szinaptikus résből a környező térbe. Ez a mechanizmus kevésbé hatékony, mint a visszavétel vagy az enzimatikus lebontás, de hozzájárul a neurotranszmitter koncentrációjának csökkentéséhez a résben.
A neurotranszmitterek eltávolítása a szinaptikus résből kulcsfontosságú a szinaptikus transzmisszió szabályozásához és a neuronális áramkörök megfelelő működéséhez.
Ezek a mechanizmusok együttesen biztosítják, hogy a neurotranszmitterek hatása időben korlátozott legyen, és a neuronok képesek legyenek gyorsan és pontosan reagálni a beérkező ingerekre. Gyógyszerek és más vegyületek befolyásolhatják ezeket a folyamatokat, ami hatással lehet az agy működésére és a viselkedésre. Például, egyes antidepresszánsok a szerotonin visszavételét gátolják, ezáltal növelve a szerotonin koncentrációját a szinaptikus résben.
Gyógyszerek és drogok hatása a szinaptikus rés működésére
A szinaptikus rés működését számos gyógyszer és drog befolyásolhatja, gyakran drasztikus módon. Ezek a szerek a neurotranszmitterek felszabadulását, kötődését a receptorokhoz, vagy a visszavételét és lebontását módosíthatják.
Egyes szerek, mint például az SSRI-k (szelektív szerotonin visszavétel gátlók), a szerotonin, egy fontos hangulatot szabályozó neurotranszmitter visszavételét gátolják a szinaptikus résből. Ennek eredményeként a szerotonin hosszabb ideig marad a résben, így több esélye van kötődni a posztszinaptikus neuron receptoraihoz, ami fokozott neurotranszmissziót eredményez. Ezt a mechanizmust használják a depresszió kezelésére.
Más gyógyszerek, például egyes fájdalomcsillapítók (opioidok), a természetes endorfinok hatását utánozzák. Az opioidok kötődnek az opioid receptorokhoz a szinapszisban, csökkentve a fájdalomérzetet és eufóriát okozva.
A stimulánsok, mint például a kokain, a dopamin, noradrenalin és szerotonin visszavételét gátolják. A dopamin, amely a jutalmazó rendszerekben játszik kulcsszerepet, a szinaptikus résben marad, ami intenzív eufóriát és függőséget okoz.
A drogok és gyógyszerek hatása a szinaptikus résre komplex és sokrétű lehet, függően a szer típusától, dózisától és az egyén genetikai hátterétől.
Bizonyos szerek közvetlenül a receptorokhoz kötődnek, vagy agonistaként, serkentve a receptor működését, vagy antagonistaként, blokkolva azt. Például a nikotin az acetilkolin receptorok agonistája, míg egyes antipszichotikumok a dopamin receptorok antagonistái.
A hosszú távú drogfogyasztás adaptációs változásokat idézhet elő a szinapszisokban, ami toleranciához és függőséghez vezet. A tolerancia azt jelenti, hogy a szer hatásának eléréséhez egyre nagyobb dózisra van szükség, míg a függőség a szer megvonásakor jelentkező kellemetlen tünetekkel jár.
A benzodiazepinek, melyeket szorongás és álmatlanság kezelésére használnak, a GABA (gamma-amino-vajsav) nevű gátló neurotranszmitter hatását erősítik. A GABA a központi idegrendszer fő gátló neurotranszmittere, és a benzodiazepinek a GABA receptorokhoz kötődve fokozzák a GABA kötődését, ami csökkenti az idegsejt aktivitását.
Vannak szerek, amelyek befolyásolják a neurotranszmitterek szintézisét vagy lebontását. Például egyes gyógyszerek gátolhatják azokat az enzimeket, amelyek a neurotranszmittereket lebontják, így növelve azok koncentrációját a szinaptikus résben.
Szinaptikus diszfunkciók szerepe neurológiai és pszichiátriai betegségekben
A szinaptikus rés a két idegsejt (neuron) közötti apró, kb. 20 nanométeres távolság, ahol az egyik neuron (a preszinaptikus) a kémiai jeleket (neurotranszmittereket) kibocsátja, a másik neuron (a posztszinaptikus) pedig ezeket felfogja. A szinaptikus diszfunkciók számos neurológiai és pszichiátriai betegségben kulcsszerepet játszanak. Ezek a diszfunkciók a neurotranszmitterek szintézisének, tárolásának, felszabadulásának, receptorokhoz való kötődésének vagy a szinaptikus résből való eltávolításának hibáit jelenthetik.
Például, a depresszió esetében gyakran alacsony a szerotonin szintje a szinaptikus résben. Ez a szerotonin transzporterek túlműködésének vagy a szerotonin felszabadulásának csökkenésének következménye lehet. Az antidepresszánsok, mint például a szelektív szerotonin visszavétel gátlók (SSRI-k), a szerotonin transzportereket gátolva növelik a szerotonin koncentrációját a szinaptikus résben, javítva ezzel a hangulatot.
A Parkinson-kór esetében a dopaminerg neuronok pusztulása a substantia nigrában dopaminhiányhoz vezet a szinaptikus résben, ami mozgászavarokat okoz. A skizofrénia esetében pedig a dopamin túlműködése, különösen a mezolimbikus pályában, a szinaptikus résben túlzott dopamin jelenlétéhez vezet, ami hallucinációkhoz és téveszmékhez vezethet. Az antipszichotikumok a dopamin receptorokat blokkolva csökkentik a dopamin hatását.
Az Alzheimer-kór esetében az acetilkolin szintjének csökkenése a szinaptikus résben kognitív hanyatláshoz vezet. Az acetilkolinészteráz gátlók, melyek az acetilkolin lebontását végző enzimet gátolják, növelik az acetilkolin koncentrációját, enyhítve a tüneteket.
A szinaptikus diszfunkciók nem csupán a neurotranszmitterek mennyiségének változásaiban nyilvánulnak meg, hanem a receptorok számában, érzékenységében és eloszlásában is.
A fájdalomérzékelés is szorosan összefügg a szinaptikus folyamatokkal. Például, a krónikus fájdalom szindrómák hátterében gyakran a szinaptikus plaszticitás megváltozása áll, ami a fájdalomjelek túlzott felerősödéséhez vezet.
A szinaptikus diszfunkciók megértése kulcsfontosságú a neurológiai és pszichiátriai betegségek hatékonyabb kezelésének kidolgozásához. A célzott terápiák kifejlesztése, amelyek a specifikus szinaptikus hibákat korrigálják, jelentős előrelépést jelenthet a betegek életminőségének javításában.
A szinaptikus rés kutatásának módszerei
A szinaptikus rés, a neuronok közötti apró térköz tanulmányozása kulcsfontosságú az idegrendszer működésének megértéséhez. A kutatók számos módszert alkalmaznak a rés szerkezetének és funkciójának feltérképezésére. Az elektronmikroszkópia nagy felbontású képet nyújt a rés morfológiájáról, lehetővé téve a szinaptikus vezikulák és a receptorok eloszlásának vizsgálatát.
A patch-clamp technika segítségével közvetlenül mérhetők az ionáramok a posztszinaptikus neuronban, így következtethetünk a neurotranszmitterek hatásaira és a receptorok aktivitására. A neurotranszmitterek koncentrációjának mérésére gyakran használnak mikrodialízist és elektrokémiát. Ezen módszerekkel valós időben követhető a neurotranszmitterek felszabadulása és eltávolítása a résből.
A genetikai manipuláció, például a génkiütés (gene knockout), lehetővé teszi bizonyos fehérjék vagy receptorok szerepének vizsgálatát a szinaptikus transzmisszióban.
A fluoreszcens mikroszkópia különböző változatai, mint például a konfokális és a kétfoton-mikroszkópia, lehetővé teszik a szinapszisok élő sejtekben történő vizualizációját és a szinaptikus aktivitás nyomon követését fluoreszcens jelölők segítségével. A computációs modellezés pedig segíthet integrálni a kísérleti adatokat és szimulálni a szinaptikus transzmisszió komplex folyamatait, előrejelzéseket téve a rendszer viselkedésére.
Bár minden tőlünk telhetőt megteszünk azért, hogy a bemutatott témákat precízen dolgozzuk fel, tévedések lehetségesek. Az itt közzétett információk használata minden esetben a látogató saját felelősségére történik. Felelősségünket kizárjuk minden olyan kárért, amely az információk alkalmazásából vagy ajánlásaink követéséből származhat.